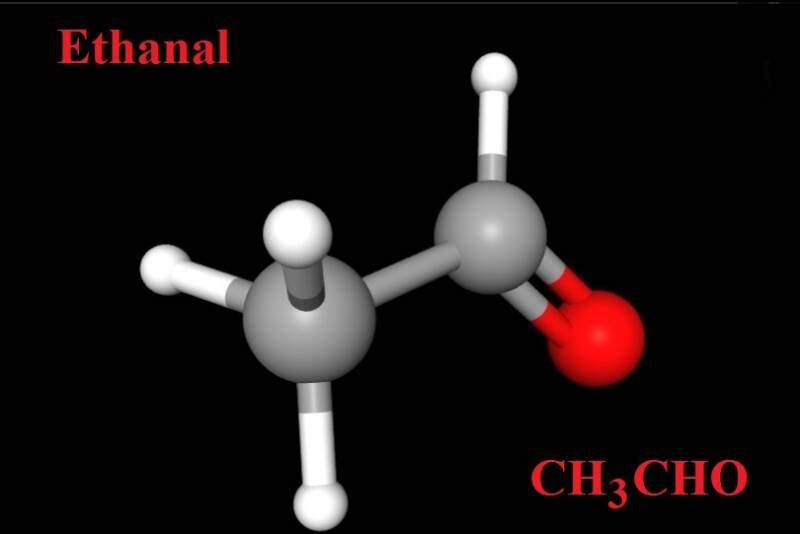




The yeast cell, alcohols and the citric acid cycle. English version.
The yeast cell is a living organism that is often used in, for example, bread baking, in order to make the bread porous, tastier and with a different character. The yeast has an overflow metabolism, which means that if it becomes supersaturated with sugar, it produces ethanal, CH3CHO, which in the next step is converted to ethanol, CH3CH2OH. What happened was that alcohol dehydrogenase (a protein, an enzyme/catalytic converter) caused a normal chemical reaction to go in an opposite direction that is standard in e.g. the human body; 2 CH3CH2OH (your ethanol intake) + O2 (your oxygen intake) ---> 2 CH3CHO (ethanal) + 2 H2O After drinking alcohol, this reaction usually takes place as we saw, where alcohols are split into aldehydes. Such are denoted -CHO, and there is a double bond between the oxygen and the carbon. When a primary alcohol is exposed to oxygenation, formyl groups, -CHO, arise. In the case of a stronger oxidation, you instead first get formyl groups and then directly after carboxyl groups, -COOH.
In the first step during the oxidation of the primary alcohol (ethanol, it is primary because the OH-bound carbon binds to just one other carbon in the structure), the oxygen took 2 hydrogens, H, with it, and it became water as a byproduct. In the second step during oxygenation, an extra oxygen was instead attached to the molecule, so that you went from formyl group to a carboxyl group, -COOH. Another example about a similar alcohol is polypropylene; (this is the alkene in question with a double bond) CH3CH=CH2 + (Sulfuric acid) H2SO4 ---> (ethane methanesulfonate) C3H8SO4 (+ add water, H2O) ---> (2-propanol) C3H7OH + H2SO4 This was how a secondary alcohol was obtained instead (the OH-bound carbon binds to two other carbons in the structure), and sulfuric acid, H2SO4, was formed again. Both ethanol and 2-propanol are monohydric alcohols where you only find a single hydroxyl group, and in a structural formula you place the -OH group wherever you want, because the carbons are moved around on the bond. The alcohols also form Iso-compounds, which means that different variants (ramifications) can be found.
You can also get ethanol that is otherwise formed from yeast, through a hydrolysis of ethylene if you want; (ethylene) C2H4 (g) + H2O (g) ---> (ethanol) C2H5OH (g) where mixed sulfuric acid, H2SO4, was the catalyst in the laboratory. Ethylene is an alkene (monounsaturated, hydrogen "deficiency" exists, therefore a double bond) found in ripe fruit, and which causes other fruits next to it to ripen faster. The most common plastic is also made from ethylene, and the product is called polyethylene (PE). Alkenes are more reactive than alkanes (saturated structure without e.g. double bonds), and this is because there is a double bond here that is happy to open up so that new atoms will attach. During e.g. an addition reaction, the bromine molecule, Br2, can be added in the lab to cyclohexene, C6H10, and the cycloalkene in question loses the double bond between two pieces of carbon, And there remains a ring where two bromine atoms have been attached to each carbon in the structure. The altered hydrocarbon in the reaction removes the brown color of bromine water, as bromine is attached.
In the case of aldehydes (alcohols were cleaved to aldehydes in the beginning) and ketones, it is so that the aldehydes, -CHO, are reducing (obtaining electrons) and one can demonstrate that they are present in a solution with e.g. Trommer's test. In this test, first add Fehling's solution (a solution for detecting substances), which contains, inter alia, copper(ll) sulphate (copper ions and sulphate ions), and if there is e.g. glucose in the solution, which is a reducing sugar because aldehyde is present, the color of the solution will change from light blue to brick red (after a heating). It is Cu2+ that is reduced to Cu+ during the reaction, and the latter is brick red. The functional group of ketones is instead denoted R1-C(O)-R2 and acetone, CH3(CO)CH3, is the simplest of them all. There are 2 methyl groups, -CH3 (one on each side), on the molecule, and the middle carbon double-bonds to the oxygen, and these two parts are called carbonyl oxygen and carbonyl carbon.
Aldehydes also have their own carbonyl group, but otherwise there are not different hydrocarbons on each side of the molecule, only on a single side. The other side has a lone hydrogen. Methyl groups, -CH3, that sit on the molecules are very reactive and very often attach to larger molecules with a covalent bond (when atoms share electrons to achieve noble gas structure). Methyl groups are derived from methane, CH4, which is a very strong greenhouse gas. An interesting reaction about this is; (methane) CH4 + (chlorine) Cl ---> CH3 + (hydrogen chloride) HCl, and the hydrogen chloride produced destroys the ozone layer in the stratosphere (which is found 10-50 km upwards). Methyl is also available in 3 other rare forms, e.g. in anion form (minus charged). Methyl groups occur very often in the body and later research in biology draws attention to them. The methyl groups can be influenced with the right diet and exercise, and these control the expression of genes. In some cases, the methyl group can decide, for example, whether the cancer gene that has been inherited should be on or off.
Cellular respiration that takes place inside e.g. animal cells and yeast cells happens thanks to glucose. This has an aldehyde group and its therefore an aldose, that can be oxidized to a carboxylic acid, -COOH. This is how aerobic respiration occurs in the cell (when oxygen participates); (glucose) C6H12O6 + 6 O2 ---> ATP + 6 CO2 + 6 H2O. No ethanol or lactate, CH3CH(OH)COOH, formation will happen, because there is no need for the cell in this case to switch to anaerobic conditions. Obtaining by-products of a process to obtain energy without oxygen, is not relevant here. In other cases, the organism still must find a way for the vital ATP (the cell's energy currency) to be produced in the cell. In the citric acid cycle, GTP will be produced, and this can later be converted to ATP, but it is the reduction of the FAD+ and NAD+ molecules that generates more energy. NADH and FADH2 are then oxidized in the next step in the electron transport chain. This process provides energy to pump hydrogen ions around across the mitochondria's innermost membrane, and ATP is generated.
The yeast cell, alcohols and the citric acid cycle. Swedish version.
Jästcellen är en levande organism som ofta används inom t.ex. brödbakning, i syfte att göra brödet poröst, godare och med en annan karaktär. Jästen har en överflödesmetabolism, som innebär att om den blir övermätt på socker så producerar den etanal, CH3CHO, som i nästa steg omvandlas till etanol, CH3CH2OH. Det som hände var att alkoholdehydrogenas (ett protein, ett enzym/pådrivare) fick en vanlig kemisk reaktion att gå mot ett motsatt håll än vad som är standard i t.ex. människo-kroppen; 2 CH3CH2OH (ditt etanol intag) + O2 (din andning) ---> 2 CH3CHO (etanal) + 2 H2O Efter man druckit alkohol så brukar istället denna reaktion äga rum som vi såg, där alkoholer spjälkas till aldehyder. Sådana betecknas -CHO, och det finns en dubbelbindning mellan syret och kolet. När en primär alkohol utsätts för syrsättning så uppstår formylgrupper, -CHO, i fråga. Vid en starkare oxidering får man istället först formylgrupper och sedan direkt efter karboxylgrupper, -COOH.
I det första steget under den primära alkoholens oxidering (etanolens, den är primär för att det OH-bundna kolet binder till bara en enda annan kol i strukturen) så tog syret med sig 2 väten, H, och det blev vatten som en biprodukt. I det andra steget under syrsättning så fäste istället en extra syre på molekylen, så att man gick från formylgrupp till karboxylgrupp, -COOH. Ett annat exempel om en liknande alkohol är propen; (alkenen i fråga med dubbelbindning) CH3CH=CH2 + (Svavelsyra) H2SO4 ---> (Etan metansulfonat) C3H8SO4 (+ addera vatten, H2O) ---> (2-propanol) C3H7OH + H2SO4 Så fick man till en sekundär alkohol istället (det OH-bundna kolet binder till två andra kol i strukturen), samt svavelsyra, H2SO4, bildades på nytt. Både etanol och 2-propanol är envärda alkoholer där man bara hittar en enda hydroxylgrupp, och i en strukturformel placerar man ut OH-gruppen var man vill, eftersom kolen förflyttas runt på bindningen. Alkoholerna bildar även Iso-föreningar, vilket betyder att olika varianter (förgreningar) finns att finna.
Man kan även få till etanol som annars bildas från jäst, genom en hydrolys av eten om man vill; (Eten) C2H4 (g) + H2O (g) ---> (Etanol) C2H5OH (g) där utblandad svavelsyra, H2SO4, var katalysator på laboratoriet. Eten är en alken (enkelomättad, väte- ”brist” finns, därför en dubbelbindning) som finns i mogen frukt, och som får andra frukter bredvid att mogna fortare. Man tillverkar även den vanligaste plasten av eten, och produkten heter polyeten (PE). Alkener är mer reaktiva än alkaner (mättad struktur utan t.ex. dubbelbindningar), och det är så för att det här finns en dubbelbindning som gärna öppnas upp så att nya atomer ska fästa. Under t.ex. en additionsreaktion så kan brommolekylen, Br2, adderas på labbet till cyklohexen, C6H10, och cykloalkenen i fråga tappar dubbelbindningen mellan två stycken kol, och det återstår en ring där två bromatomer har fästs till varsin kol i strukturen. Det förändrade kolvätet i reaktionen tar bort den bruna färgen på bromvatten, då brom fästs bort.
När det gäller aldehyder (alkoholer spjälkades till aldehyder i inledningen) och ketoner, så är det som så att aldehyderna, -CHO, är reducerande (erhållning av elektroner händer) och man kan påvisa att de finns i en lösning med t.ex. Trommers prov. I det provet tillsätter man först Fehlings lösning (en lösning för att man ska kunna spåra ämnen), som innehåller bl.a. koppar(ll)sulfat (kopparjoner och sulfatjoner), och om det finns t.ex. glukos i lösningen, som är en reducerande sockerart för att aldehyd finns närvarande, så kommer färgen på lösningen att skifta färg från ljusblå till tegelröd (efter en uppvärmning). Det är Cu2+ som reduceras till Cu+ under reaktionen, och den sistnämnda är tegelröd. Ketonernas funktionella grupp betecknas istället R1-C(O)-R2 och aceton, CH3(CO)CH3, är den enklaste av dem alla. Det finns 2 metylgrupper, -CH3 (en på varje sida), på molekylen, och det mittersta kolet dubbelbinder till syret, och dessa två delar kallas för karbonylsyre och karbonylkol.
Aldehyder har också en egen karbonylgrupp, men i övrigt finns det inte olika kolväten på varje sida av molekylen, bara på en enda sida. Den andra sidan har ett ensamt väte. Metylgrupper, -CH3, som sitter på molekylerna är väldigt reaktiva och brukar väldigt ofta fästa till större molekyler med en kovalent binding (när atomer delar på elektroner för att uppnå ädelgasstruktur). Metylgrupper härstammar från metan, CH4, som är en mycket stark växthusgas. En intressant reaktion om detta är; (metan) CH4 + (klor) Cl ---> CH3 + (väteklorid) HCl, och väteklorid som produceras förstör ozonlagret i stratosfären (som finns 10-50 km uppåt). Metyl finns även i 3 andra sällsynta former, t.ex. i anjonform (minusladdad). Metylgrupper förekommer väldigt ofta i kroppen och senare forskning inom biologi uppmärksammar dem. Metylgrupperna går att påverka med rätt kost och träning, och dessa styr genernas uttryck. Metylgruppen kan i vissa fall t.ex. bestämma om cancergenen som gått i arv ska vara på eller av.
Cellulär andning som sker inuti t.ex. djurceller och jästceller händer tack vare glukos. Denna har en aldehydgrupp och är därför en aldos som kan oxideras till en karboxylsyra, -COOH. Såhär sker aerob andning i cellen (när syre deltar); (glukos) C6H12O6 + 6 O2 ---> ATP + 6 CO2 + 6 H2O. Ingen etanol eller laktat, CH3CH(OH)COOH, bildning kommer att hända, för att det finns inget behov för cellen i det här fallet att gå över till anaeroba förhållanden. Att få biprodukter från en process för att erhålla energi utan syre, är här inte aktuellt. I andra fall måste organismen hitta ett sätt för att den livsviktiga ATP (cellens energivaluta) ska kunna produceras i cellen ändå. I citronsyracykeln kommer GTP att produceras, och denna kan omvandlas senare till ATP, men det är reduktionen av FAD+- och NAD+-molekylerna som genererar mer energi. NADH och FADH2 oxideras sedan i nästa steg i elektrontransportkedjan. Den processen ger energi till att pumpa runt vätejoner över mitokondriens innersta membran, och då alstras ATP.










The pictures are borrowed from Google and PubChem.
B. Lundh & J. Malmquist (2009). Medicinska Ord. Lund: Studentlitteratur AB.
C. Erlanson-Albertsson (2013). Cellbiologi. Lund: Studentlitteratur AB.
J. Naumczyk (2017). Chemia środowiska. Warszawa: PWN SA.
https://blogs.scientificamerican.com/guest-blog/enzymes-the-little-molecules-that-bake-bread/ (2023-05-24)
https://www.britannica.com/science/yeast-fungus (2023-05-29)
https://www.youtube.com/watch?v=2YxTcBimxlw (2023-05-30)
https://sv.wikipedia.org/wiki/J%C3%A4sning (2023-06-10)
https://easychem.com.au/production-of-materials/renewable-ethanol/hydration-of-ethylene/?utm_content=cmp-true (2023-06-19)
http://www.portersteken.se/2013/12/olmolekyler-acetaldehyd.html#:~:text=Pyruvat%20%28som%20i%20sin%20tur%20bildats%20i%20flera,i%20omv%C3%A4nd%20riktning%20j%C3%A4mf%C3%B6rt%20med%20vid%20kroppens%20nedbrytning. (2023-06-19)
https://sv.wikipedia.org/wiki/J%C3%A4sning#J%C3%A4sningens_biokemi (2023-06-19)
https://sv.wikipedia.org/wiki/Alkoholdehydrogenas (2023-06-19)
https://www.chemicalaid.com/tools/equationbalancer.php?equation=CH3CH2OH+%2B+O2+%3D+CH3CHO+%2B+H2O&hl=en (2023-06-19)
https://sv.wikipedia.org/wiki/Aldehyd (2023-06-19)
https://ehinger.nu/undervisning/starta-har/nyheter/7555-varfor-blir-man-full-av-alkohol.html (2023-06-19)
https://sv.strephonsays.com/difference-between-primary-and-secondary-alcohol (2023-06-20)
https://www.britannica.com/science/isopropyl-alcohol (2023-06-27)
https://sv.wikipedia.org/wiki/Alken (2023-06-27)
https://www.chemicalaid.com/tools/equationbalancer.php?equation=C3H8O+%2B+H2SO4+%3D+C3H8SO4+%2B+H2O&hl=en (2023-06-27)
http://www.studera.com/tranano/kemi/Organiskkemi/Envard.html (2023-06-27)
https://naturvetenskap.se/kemi/hogstadiekemi/organisk-kemi/alkoholer/ (2023-06-27)
https://sv.mosg-portal.com/identify-types-isomers-6974436-7122 (2023-06-27)
http://www.studera.com/tranano/kemi/Organiskkemi/Isoforen.html (2023-06-27)
http://www.learnify.se/learnifyer/ObjectResources/5cf3c88c-e2df-4f46-b06c-314a82e7e614/index.html (2023-06-27)
https://ehinger.nu/undervisning/kurser/kemi-2/lektioner/organiska-molekylers-struktur-och-funktion/alkener.html (2023-07-01)
https://ehinger.nu/undervisning/kurser/kemi-2/laborationer-och-ovningar/organisk-kemi/7222-demo-omattade-kolvaten-avfargar-bromvatten.html#:~:text=Tills%C3%A4tt%20droppvis%20bromvatten%20till%20provr%C3%B6ret%20med%20cyklohexan.%20Bromet,med%20cyklohexenet%2C%20och%20den%20r%C3%B6dbruna%20f%C3%A4rgen%20f%C3%B6rsvinner%20direkt. (2023-07-02)
https://ehinger.nu/undervisning/kurser/kemi-2/lektioner/mer-om-organiska-reaktioner/aldehyder-och-ketoner.html (2023-07-02)
https://www.synonymer.se/sv-syn/aldehyd (2023-07-02)
https://kunskaper.se/vad-ar-en-keton-definition-fran-kunskaper-se/#:~:text=Ketoner%20%C3%A4r%20organiska%20f%C3%B6reningar%20som%20inneh%C3%A5ller%20en%20karbonylgrupp.,allm%C3%A4nt%20anv%C3%A4nda%20ketonerna%20%C3%A4r%20aceton%2C%20metyletylketon%20och%20cyklohexanon. (2023-07-02)
https://sv.wikipedia.org/wiki/Trommers_prov (2023-07-02)
https://www.dagensdiabetes.se/index.php/alla-senaste-nyheter/2977-epigenetik-metylgrupper-pa-vara-gener-paverkas-av-fysisk-aktivitet-kost-livsstil-alexander-perfilyev-avhandling-lund-t2dm#:~:text=Metylgrupperna%20kan%20man%20p%C3%A5verka%20p%C3%A5%20olika%20s%C3%A4tt%2C%20med,utvecklingen%20av%20sjukdomar%20som%20cancer%20och%20typ%202-diabetes. (2023-07-02)
https://sv.strephonsays.com/difference-between-ethyl-and-methyl#:~:text=Metylgruppen%20har%20en%20ledig%20punkt%20d%C3%A4r (2023-07-03)
https://en.wikipedia.org/wiki/Atmospheric_methane (2023-07-03)
https://www.smhi.se/kunskapsbanken/klimat/klimatpaverkan/ozonskiktet-och-klimatet-1.3830#Begr%C3%A4nsat%20Utsl%C3%A4pp%20Av%20v%C3%A4xthusgaser (2023-07-03)
https://www.ehinger.nu/undervisning/kurser/kemi-2/lektioner/biomolekyler/reducerande-och-icke-reducerande-sockerarter.html (2023-07-03)
https://sv.wikipedia.org/wiki/Anaerob (2023-07-03)
Add comment
Comments